研究紹介
私達の研究室では、細菌やウイルスによる感染症について、その仕組を分子レベルで理解し、それにより効果的な予防法、診断法、治療法へと展開できる知見を得るための基盤研究を推進しています。特に感染の場において、病原体と宿主細胞それぞれにもたらされるストレス応答機構について、最新の解析技術を駆使して研究しています。現在主として下記の研究プロジェクトに取り組んでいます。
研究テーマ(Research Projects)
Ⅰ. 細菌のイオウ代謝と抗酸化防御機構の解明
Ⅱ. 新規メタロβラクタマーゼ阻害剤
Ⅲ. 腸管出血性大腸菌毒素(SubAB)の作用機序解析
Ⅳ. 活性イオウによる自然炎症・感染免疫の制御機構の解明
Ⅴ. 活性イオウの抗ウイルス作用の解明
Ⅵ. ヒト免疫不全ウイルス(HIV-1)の細胞内侵入機構の解析
Ⅷ. ヒト内在性ウイルス (HERV) とレトロトランスポゾン機構の解明
Ⅸ. ヒトT細胞白血病ウイルス (HTLV-1)のエンベロープタンパク質と受容体との相互作用の解析
Ⅹ. 高分子抗癌剤に関する研究
Ⅺ. 薬剤耐性菌の蔓延とその防止に関する研究
VI〜IXはウイルス部門の研究テーマ(リンク)
Ⅰ. 細菌のイオウ代謝と抗酸化防御機構の解明
Elucidation of Sulfur Metabolism and Antioxidant Defense Mechanism in Bacteria
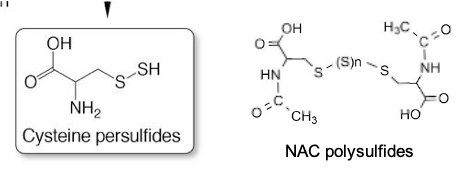
イオウ(S)を含む官能基のチオール(-SH)を持つアミノ酸、システイン(Cys)に硫化水素(H2S)が反応して生成する物質、システインパースルフィド(CysSSH)やシステインポリスルフィド(CysSSnH、n>1)が、細菌の代謝物として存在することが、先代教授、赤池孝章博士をはじめとする当研究室のメンバーらによって見出されました。これらのシステインパースルフィドは単独のチオールや硫化水素よりも強力な抗酸化力や求核性(電子を与えて新たな結合を作りやすい)を持つことから、活性イオウ(あるいは超イオウ)分子と呼ばれています。
当研究室では質量分析計などを駆使して活性イオウの分析手法を発展させ、さらには実験的に活性イオウを付加することのできる物質、N-アセチルシステインポリスルフィド(NAC polysulfide)を開発して利用するなどの工夫をし、細菌内での新しいイオウ代謝の役割を次々に明らかにしています。最近では、細菌が主要な抗生物質であるβラクタム抗菌剤を不活(耐性)化するメカニズムとして、菌体内の活性イオウがβラクタム抗菌剤に作用し、カルボチオ酸に分解してから排出することを報告しました(ニュースリリース参照)。
Cysteine persulfide (CysSSH) and cysteine polysulfide (CysSSnH, n > 1), which are produced by the reaction of hydrogen sulfide (H2S) with cysteine (Cys), an amino acid with a thiol (-SH), were found as bacterial metabolites by the 6th Prof. Takaaki Akaike and other members of our laboratory. These cysteine persulfides are called reactive sulfur (or super-sulfur) species because they have stronger antioxidant and nucleophilic properties than thiols or hydrogen sulfide alone (i.e., easily form new bonds by giving up electrons).
We have developed analytical methods for reactive sulfur species using mass spectrometry and other techniques, and have also developed and used N-acetylcysteine polysulfide (NAC polysulfide), that can give reactive sulfur species experimentally. The role of sulfur metabolism in bacteria, which had not been illuminated in the past, has been clarified one after another. Recently, we reported that reactive sulfur species in bacteria acts on β-lactams, major antibiotics and decomposes them into carbothioic acid which is transported to the extracellular space as a mechanism of bacterial inactivation (resistance) to β-lactams (see news release).
Ⅲ. 腸管出血性大腸菌毒素(SubAB)の作用機序解析
Analysis of The Mechanism of Action of Enterohemorrhagic Escherichia Coli Toxin (SubAB)

Subtilase cytotoxin(SubAB)は、オーストラリアで起こった集団食中毒の原因菌O113株という腸管出血性大腸菌*から見つかった腸管毒素です。SubABは宿主細胞に取り込まれると小胞体(ER)のシャペロンタンパク質であるBiPを切断しERストレス性の細胞死を起こします。感染病態におけるSubABの病原性はほとんど分かっていません。私達はSubABが細胞死を起こすメカニズムを解明してきました。そのなかで、SubABが宿主のいくつかのタンパク質を利用して病原性を発揮することがわかってきました。また、SubABが宿主の自然免疫【一酸化窒素(NO)やサイトカインの産生】を阻害して大腸菌の生き残りを助け、感染を悪化させる可能性を見出しました。一方、NOなどの活性窒素種がSubABの病原性を抑えてくれることが分かってきました。現在、培養細胞や動物モデルを用いて宿主内での毒性発現機構や免疫に及ぼすSubABの影響を解析し、病態との因果関係の解明に取り組んでいます。
*腸管出血性大腸菌:食中毒の原因菌で、O157株が最も有名です。この菌に感染すると血便などを起こし、死に至ることもあります。主な病原因子は志賀毒素ですが、SubABなど複数の病原因子を産生する菌は病原性が高くなる危険性があるため、その制御法を見つける研究はとても重要と考えられます。
Subtilase cytotoxin(SubAB)was identified as an enterotoxin from Enterohemorrhagic Escherichia coli (EHEC) O113 strain which was responsible for an outbreak in Australia. SubAB translocates to the endoplasmic reticulum (ER) in host cells and cleaves the chaperone BiP, leading to the ER stress-mediated cell death. To date, the pathogenicity of SubAB in EHEC infections remains unclear. We have investigated the mechanisms how SubAB induces cell death. Several evidences suggest that SubAB exhibits the toxicity using host proteins. Previously, we demonstrated that SubAB inhibited host innate immunity [nitric oxide (NO) and cytokines production], which enhanced E. coli survival in macrophages. On the other hand, reactive nitrogen species such as NO suppress the SubAB pathogenicity. Using culture cells and animal infection models, we investigate to elucidate the causal relationship with the infections by analyzing the mechanism of toxicity expression in the host and effects of SubAB on host immune system.
Ⅴ. 活性イオウの抗ウイルス作用の解明
Elucidation of The Antiviral Effects of Reactive Sulfur Species

準備中
In preparation
Ⅺ. 薬剤耐性菌の蔓延とその防止に関する研究
Research on The Spread of Drug-Resistant Bacteria and Its Prevention

準備中
In preparation
Ⅱ. 新規メタロβラクタマーゼ阻害剤
Novel Metallo-β-Lactamase Inhibitors

準備中
In preparation
IV. 活性イオウによる自然炎症・感染免疫の制御機構の解明
Regulation of Innate Inflammation and Infectious Immunity by Reactive Sulfur Species
Cell Chem Biol. 2019 May 16;26(5):686-698.e4.
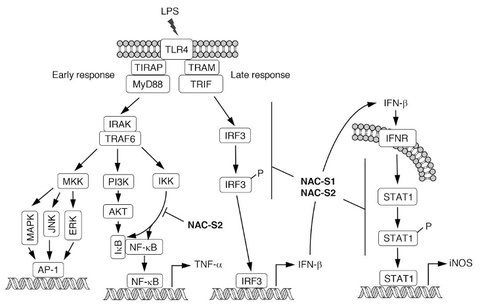
「I. 細菌のイオウ代謝と抗酸化防御機構の解明」で述べた、細菌の代謝物として見出された活性イオウ(システインパースルフィドやポリスルフィド)は、原核生物(細菌)だけでなく、真核生物、哺乳類の生体内に広く存在することが明らかになっています。
一方、我々人間を含む哺乳類における生体防御のシステムとして、外来異物や損傷組織の構成分子や分泌物を認識して炎症や免疫応答を活性化するパターン認識受容体というものが細胞膜(Toll-like receptors: TLRs)や細胞質(NOD-like receptors: NLRs, RIG-I like receptors: RLRs)に存在しています。実験的に硫化水素(H2S)を添加すると、このパターン認識受容体の応答が抑制されることが報告されていましたが、当研究室ではNAC polysulfideを用いて実験的に活性イオウを添加すると、パターン認識受容体応答の一つ、TLRs応答が硫化水素よりもはるかに強力に抑制されることを見出しました。また別のパターン認識受容体応答NLRsの一つ、NLRP3インフラマソームの活性化では炎症時に活動するマクロファージが細胞内の活性イオウを外に排出して(つまり中の活性イオウを減らして)いることを明らかにしました。つまり、活性イオウはパターン認識受容体を介した炎症や免疫応答に対して抑制的に働くと考えられます。
本来は生体を守るための炎症や免疫応答ですが、これらの応答が過剰に起こってしまうと炎症性疾患が進展することが知られています。当研究室の研究は炎症性疾患の進展に対する治療に新たなアプローチを提供することが期待されます。
Recent advances in the development of analytical methods for detection and quantification of reactive sulfur species (RSS) have revealed that RSS, including persulfides and polysulfides, are abundant in both prokaryotes and eukaryotes. Accumulating evidence has suggested that RSS play important roles in diverse biological processes. However, the effects of RSS on host immune and inflammatory responses remain unclear. By using newly developed polysulfur donor (NAC polysulfides), we demonstrated that NAC polysulfide can inhibit not only Toll-like receptor (TLR) 4 signaling but also TLR2 and TLR3 signaling by suppressing IκB/NF-κB phosphorylation. In addition, NAC polysulfides strongly suppressed IFN-β dependent inflammatory responses by both inhibiting IFN-β production as well as STAT1 phosphorylation (Figure above). More importantly, NAC polysulfide treatment protected mice from lethal endotoxin shock model. Our findings suggest that RSS are closely involved with immune function regulation, and that inflammatory pathology can be improved by artificially increasing RSS. In the future, we expect to target on NLRP3 inflammasome that is another key inflammatory actor to explore the effect of RSS, and to develop a new anti-inflammatory therapy.
Ⅹ. 高分子抗癌剤に関する研究
Research on Polymeric Anticancer Agents
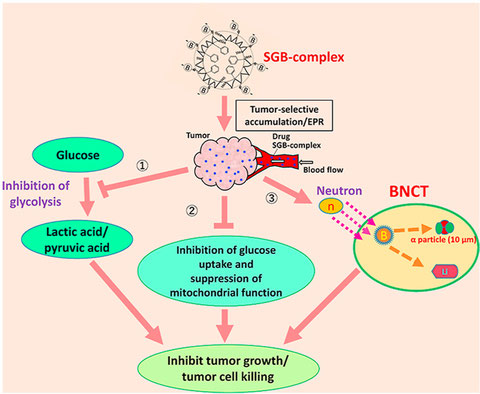
当研究室5代目教授、故前田浩博士らによって、がん組織では栄養を届ける周囲の血管が未熟なため、正常な組織では流出しない高分子化合物が血管外部に流出しやすいこと、また周囲のリンパ管も未発達であることから、流出したこれら高分子化合物ががん組織に留まりやすいこと、が見出されました。この現象はEPR(enhanced permeability and retention)効果と呼ばれています。
一方、がんの治療に用いられている化学療法剤や、ホウ素(10B)と中性子との核反応を利用したホウ素中性子捕捉療法(BNCT)などでは、いかにがん細胞やがん組織に選択的に働かせられるかが重要なポイントとなっています。
そこで当研究室ではEPR効果を発揮できるように、スチレンマレイン酸共重合体(SMA)などを結合させて高分子化した化学療法剤やホウ素を作成し、がん細胞や実験動物の腫瘍に対する影響を調べています。
最近の検討では、SMAとグルコサミンとホウ素からなる複合体を作成して、がん細胞やがん組織への影響を単体のホウ素と比較したところ、より効果的にがん組織に蓄積し、またがん細胞に対して優れた増殖抑制効果を示しました。これらの検討がより有効ながん治療法の確立に寄与することが期待されます。
The late Dr. Hiroshi Maeda, the 5th professor of our laboratory, and his colleagues discovered that high-molecular compounds that do not flow out of normal tissues tend to flow out of blood vessels in tumor tissues because the surrounding blood vessels that deliver nutrients are immature, and that these high-molecular compounds tend to stay in tumor tissues because the surrounding lymphatic vessels are also immature. This phenomenon is called the EPR (enhanced permeability and retention) effect.
On the other hand, chemotherapeutic agents and boron neutron capture therapy (BNCT), which utilize the nuclear reaction between boron (10B) and neutrons, are applied to treat tumor, and it is important to selectively work on tumor cells and tissues.
We prepare polymerized chemotherapeutic agents and boron conjugated with styrene-maleic acid copolymer (SMA) to exert EPR effects, and are investigating their effects on tumor cells and tumors in experimental animals.
In a recent report, we prepared a complex consisting of SMA, glucosamine, and boron, and compared its effects on tumor cells and tissues with those of single boron, and found that it accumulated more effectively in tumor tissues and showed excellent growth inhibitory effects on tumor cells. Our studies are expected to contribute to the establishment of more effective tumor treatment methods.
国立大学法人 熊本大学
大学院生命科学研究部 微生物学講座
〒860-8556
熊本県熊本市中央区本荘1丁目1番1号
※基礎研究棟 9階 911号室
Department of Microbiology
Graduate School of Medical Sciences
Kumamoto University
1-1-1 Honjo, Chuo-ku, Kumamoto-shi, 860-8556 JAPAN
